

1.《 医疗器械经营许可变更申请表》;
2.《医疗器械经营许可证》复印件;(交验原件)
3.变更企业名称的,还应提交变更后的营业执照复印件;(交验原件)
4.变更法定代表人的,还应提交(1)变更后的营业执照复印件;(2)法定代表人的身份证明、学历或者职称证明●复印件;(交验原件)
5.变更企业负责人↘的,还应提交:(1)企业负责人的身╳份证明、学历或者职称证明复印件;(2)企业法人的非法人分支机构还应提交上级法人企业的任免决定书及变更后的营业执照复印件;(交验原件)
6.变更住∩所的,应提交变更后的营业执照复印件(交验原件);
7.凡申请企业申报材料时,具体办理人员不是法定代♂表人或负责人本人的,企业应当提交《 授权委托书》;
8.申报材料真实性自我保证声明,并对材料作出★如有虚假承担法律责任ㄨ的承诺。
(对于已取得⊙《医疗器械经营许可证》的经营企业,在办理《第二类医疗器械经营备案凭证》备案事项时,已在其许可事项中已提交的申请材料可不重复提交)
(一)营业执照、组织机构代码证复印件
(二)申请企业持有的所生产医疗器械的注册证及产品技术要求复印件
(三)法定代表人、企业负责人身份证明复印件
(四)生产、质量和技术负责人的身份、学历、职称证明复印件
(五)生产管理、质量检验岗位从业人员学历、职称一览表
(六)生产场地的证△明文件,有特殊生产环境要求的还应当提交设施、环境的证明文件复印件
(七)主要生产设备和检验设备目录
(八)质量手册和程序文件
(九)工艺流程图
(十)经办人授权证明
(十一)其他证明资料
1、《医疗器械委托生产备案表》;
2、委托生产医疗器械的注册证复印件;
3、委托方和受托方企业营业执照复印件;
4、受托方的《医疗器械生产许可证》(含《医疗器々械生产产品登记表》)或《医疗器械生产企业许可证》复印件;
5、委托生产合同复印件;
6、委托生产不属于按照创新医疗器械特别审批程序审批的境内医疗器械的,还应当提交委托方的《医疗器械生产许可证》(含《医疗器♂械生产产品登记表》)或《医疗器械生产企业许可证》复印件;属于按照创新医疗器械特别审批程序审批的境内医疗器械的,应当提交创新医疗器械特别审批证明资料。
7.申请材料真实性的自我保证声明,包括企业对材料作出如有虚假承担法律责任的承诺。
8.凡申请企业申报材料时,办理人员不是法定代表人或负责人本人,企业应当提交《授权委托书》。
1、《医疗器械生产许可延续申请表》;
2、《医疗器械生产许可证》(含《医疗器械生产产品登记表》)或《医疗器械生产企业许可证》正副本复印件;
3、申请企业持有的所生产医疗器械的注册证复印件;
4、申报材料真实性的自我保证声明,包括企业对材料作出如有虚假承担法律责任的承诺;
5、凡申请企业申报材料时,办理人员不是法定代表人或负责人本人的,企业应当提交《授权委托书》。
1、《医疗器械生产许可变更申请表》;
2、《医疗器械生产许可证》(含《医疗器械生产产品登记表》)或《医疗器械生产企业许可证》正副本复印件;
3、 企业变更的情况说明;
4、申请材料真实性的自我保证声明,包括企业对材料作出如有虚假承担法律责任的承诺;
5、凡申请企业申报材料时,办理人员不是法定代表人或负责人本人的,企业应当提交《授权委托书》;
6、所提交申报资料的电子版文件(每个电子文件不得大于10M)。
增加生产产品的,还应提交:
(1)增加的所生产医疗器械的注册证及产品技术要求复印件;
(2)主要生产设备和检验设备目录;
(3)所生产产品的工艺流程图,并注明主要控制项目和控制点▓,包括关键和特殊工序的设备、人员及工艺参数控制的说明;
如增加产品为受ㄨ托生产,还需提交:
(1)委托方和受托方营业执照复印件;
(2)受托方《医疗器械生产许可证》复印件;
(3)委托方医疗器械委托生产备案凭证复印件;
(4)委托生产合同复印件;
(5)委托生产医疗器械拟采用的说明书和标签样稿;
(6)委托方对受托方质量管◣理体系的认可声明;
(7)委托方关于委托生产医疗器械质量、销售及售后服务责任的自我保证声明;
生产地址非文字性变更的,还应提交:
(1)生产场地的证明文件(规划用途或设计用途不应该为“住宅”),包括租赁协议、房产证明(或使用权证明)的复印件;厂区位置路线图、厂区总平面图、主要生产车间布置图,有洁净要求的车间,须标明功能间及人流、物流走向同时提供洁净室的合格检测报告复印件(检测报告应是一年内的符合《无菌医疗器具生产管理规范》(YY0033)的合格检测报告);
(2)所生产产品的工艺流程图,并注明主要控制项目和控制点,包括关键和特殊工序的设备、人员及工艺参数控制的说明;
如企业同时变更企业名称、法定代表人、企业负责人、住所或生产地址文※字性变更的,应按照本程序合并办理,并还应提交以下申请材料:
变更企业名称,应提交:
工商行政管理部门出具的变更后的《营业执照》副本复印件;
变更住所、法定代表人的,应提交:
(1)工商行政管理部门出具的变更后的《营业执照》副本复印件;
(2)变更法定代表人的需同时提交变更后法定代表人身份证明复印件;
变更企业负◥责人的,应提交:
变更后企业负责人的身份证明复印件;
生产地址文字性变更的,应提交:
生产地址文字性变更的相关证明文件;
1.《 第二类医疗器械经营备案表》;
2.营业执照复印件(交验原件);
3.法定代表人、企业负责人、质量负↑责人的身份证明、学历或者职称证明复印件(对于统一采购渠道,采取连锁经营的非法人零售企业,提供连锁企业总部质量负责人身份证明、学历或者职称证明复印件);(交验原件)
4.组织机构与部门设置说明;
5.经营场所、库房的地理位置图、平面图(注明面积)、库房的产权证明及使用权证明复印件;(委托贮存的,应提交经营场所地理ξ位置图、平面图(注明面积)和与被委托方签署的书面协议复印件、被委托方的《第二类医疗器械经营备案凭证》复印件)
6.经营设施、设备目录;
7.经营质量管理制度、工作【程序等文件目录;
8.计算机信息管理系统基本情况介绍和功能◣说明(如有);
9.凡申请企业申报材料时,具体办理人员不是法定代表人或负责人本人,企业应当提交《 授权委托书》;
10.申报材料真实性自我保证声明,并对材料作出如有虚假承担↑法律责任的承诺。
1.《 医疗器械经营许可延续申请表》;
2.营业执照复印件(交验原件);
3.《医疗器械经营许可证》复印件;(交验原件)
4.法定代表人、企业负责人、质量√负责人的身份证明、学历或者职称证明复印件(对于统一采购渠道,采取连锁经营的非法人零售企业,提供连锁企业总部质量负责人身份证明、学历或者职称证明复印件);(交验原件)
5.组织机构与部门设置说明;
6. 经营场所、库房的地理位置图、平面图(注明面积); 库房的产权证明及使用权证明;跨辖区设库的,应提交《医疗器械经营企业跨辖区设置库房备案表》;(委托贮存的,应提交经营场所地理◥位置图、平面图(注明面积)和与被委托方签署的书面协议复印件、被委托方的《医疗器械经营许可证》复印件)
7.经营设施、设备目录;
8.经营质量管理制度、工作程序等文件目录;
9.计算机信息管理系统基本情况介绍和功能说明;
10.凡申请企业申报材料时,具体办理人员不是法定代表人或负责人本人的,企业应当提交《 授权委托书》;
11.申报材料真实性自我保证声明,并对材料作出如有虚假承担法律责任的承诺;
1.医疗器械经营许可申请表
2.营业执照复印件
3.法定代表人、企业负责人、质量负责人的身份证明、学历或者职称证明复印件
4.组织机构与部门设置说明
5.经营场所、库房的地理位置图、平面图(注明面积);库房的产权证明及使用权证明复印件
6.经营设施、设备目录
7.经营质量管理制度、工作程序等文件目录
8.计算机信息管理系统基本情况介绍和功能说明
9.申报材料真实性自我保证声明
CE认证咨询方案
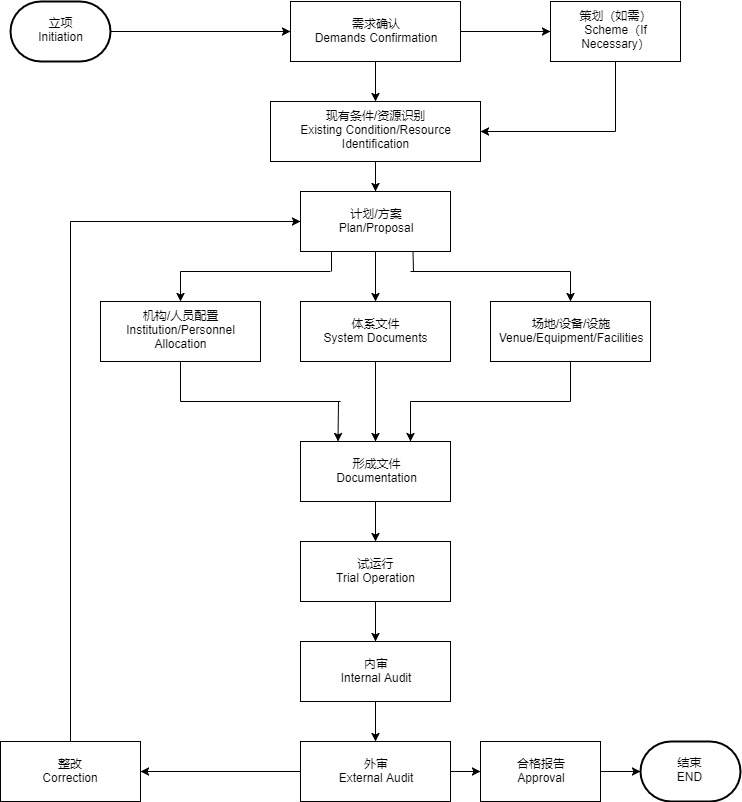
1、现状调查和←诊断:了解产品技术文件现状,根据调查和诊断结果修改本计划(必要时);
2、培训1:EN ISO 13485:2003/AC:2009、 EN ISO 14971:2009、 MDD、CE技术文件编写等;
3、编写/修改质量管理体系文件:质量手册、程序文件等 ;
4、准备样机/样品
5、产品检测
6、准备、整理、编写部分CE技术文件:产品描述、产品标准、风险管理报告、图纸、物料质量╱标准、工艺文件、检验规范或规程、生产和检验用表、特殊过程的确认资料、(自测和/或第三方检测)检测报告、临床资料、标签和说明书等 、编写其它CE技术文件(基本要求检查︻表、依据的法规、标准清单、欧盟代表授权书、符合性声明等)
【说明】:CE技术文件见清单。
7、讨论、修改、批准文件
8、文件印刷、发放
9、培训2:质量手册、程序文件、管理制度等技术文件;
10、实施质量管理体系文件:按照体系文件开展工作将工作结果形成记录;
11、第1次内审
12、第2次内审
13、管理评审
14、认证审核(外审)
15、整改
16、取证